Konfigurasi Elektron dan Elektron Valensi – Selamat datang di BioFar.ID, situs (blog) farmasi dan linaritas keilmuannya. Dan, pada kesempatan kali ini, kami bakal sharing pengetahuan mengenai Konfigurasi Elektron, beberapa pembahasan utamanya yaitu pengertian konfigurasi elektron, sejarahnya, konfigurasi elektron berdasarkan kulit atom, elektron valensi, peraturan untuk menentukan konfigurasi elektron, cara penulisan, konfigurasi elektron ion, dan hubungannya dengan sistem periodik unsur.
Elektron mengorbit pada tingkat energi tertentu yang disebut dengan kulit. Kulit elektron yaitu sekumpulan orbital dengan tingkat energi sama. Selain adanya kulit, ada juga sub kulit yang merupakan sekumpulan orbita-orbital yang mempunyai label orbital yang sama, yakni yang mempunyai nilai n dan l yang sama. Hingga tiga orbital 2p membentuk subkulit. Pemodelan ini di buat oleh Neils Bohr yang merupakan orang pertama mengusulkan perioditas dalam tabel periodik serta bisa di uraikan dengan struktur elektron dalam atom.

Lantas, setelah penjelasan di atas, apakah itu konfigurasi elektron?
DAFTAR ISI:
Pengertian Konfigurasi Elektron
Konfigurasi elektron adalah susunan elektron-elektron pada suatu atom, molekul dan struktur fisik lainnya. Sama dengan partikel elementer yang lain, elektron mengikuti hukum mekenika kuantum serta menampilkan beberapa sifat partikel ataupun gelombang.
Pengetahuan atas konfigurasi elektron atom-atom amat bermanfaat dalam membantu pemahaman struktur tabel periodik unsur-unsur. Konsep ini juga beguna dalam menjelaskan ikatan kimia yang melindungi atom-atom tetap bersama.
Sejarah Konfigurasi Elektron
Awalnya, Neils Bohr mengajukan jenis atom Bohr yang mana kulit-kulit elektronnya berupa orbit dengan jarak yang tetap dari inti atom. Konfigurasi awal Bohr tidak sama dengan yang saat ini dipakai: misalnya sulfur berkonfigurasi 2. 4. 4. 6 dari pada 1s2 2s2 2p2 dst.
Satu tahun kemudian, E. C Stoner memasukkan bilangan kuantum ketiga kedalam gambaran kulit elektron dan dengan benar memperkirakan struktur sulfur sebagai 2. 8. 6. Namun baik Bohr ataupun Stoner tidak bisa menjelaskan dengan baik perubahan spektra atom dan medan magnet.
Lantas, dengan meminta pertolongan Wolfgang Pauli, yang menyadari kalau dampak Zeeman disebabkan oleh elektron terluar atom. Ia juga dapat menghasilkan kembali struktur kulit stoner yang benar dengan pemasukan satu bilangan kuantum ke empat.
Persamaan yang lain yakni Schodinger menghasilkan tiga dari empat bilangan kuantum sebagai konsekwensi penyelesaian untuk atom Hidrogen. Penyelesaian ini menghasilkan orbital-orbital atom yang bisa kita temukan dalam buku-buku teks kimia. Kajian spektra atom bisa ditetapkan secara uji coba yang pada akhirnya menghasilkan aturan empiris untuk urutan orbital atom mana yang terlebih dulu di isi elektron.
Konfigurasi Elektron Berdasarkan Kulit Atom
Konfigurasi elektron di tiap kulit atom bisa terisi elektron maksimum 2n2, di mana n yaitu urutan kulit atom:
- Bila n = 1 2n2 sama juga dengan 2 elektron
- Bila n = 2 2n2 sama juga dengan 8 elektron
- Bila n = 3 2n2 sama juga dengan 18 elektron
- Bila n = 4 2n2 sama juga dengan 32 elektron
Tiap kulit mempunyai lambang di mana K sama juga dengan kulit pertama dekat dengan inti atom, L setelahnya, M setelah L, dan N setelah M. Banyaknya kulit yang terisi elektron menunjukkan periode. Elektron disusun sedemikian rupa pada masing-masing kulit dan di isi maksimum sesuai daya tampung kulitnya. Bila masih ada sisa elektron yang tidak dapat lagi ditampung pada kulit itu diletakkan pada kulit berikutnya.
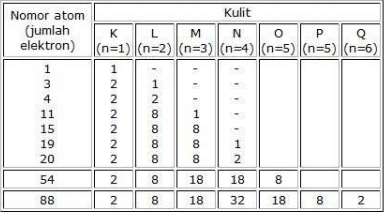
Tabel di atas yaitu pengisian konfigurasi elektron pada atom golongan paling utama.
Elektron Valensi
Elektron yang berperan dalam reaksi pembentukan ikatan kimia serta dalam reaksi kimia yaitu elktron terluar atau elektron valensi. Jumlah elktron valensi ditetapkan berdasarkan elektron yang ada pada kulit terakhir dari konfigurasi elektron atom itu. Unsur yang mempunyai jumlah elektron valensi yang sama akan mempunyai sifat kimia yang sama juga.
Tabel di atas yaitu tabel penentuan jumlah elektron valensi sekaligus hubungan konfigurasi elektron serta elektron valensi.
Peraturan untuk Menentukan Konfigurasi Elektron
Dalam penentuan konfigurasi sebuah atom, tidak dapat kita dengan mudahnya melakukannya tanpa mengetahui sebagian ketentuannya.
Ada 3 ketentuan yang perlu diperhitungkan yakni azas aufbau, larangan pauli serta kaidah hund.
Azas Aufbau
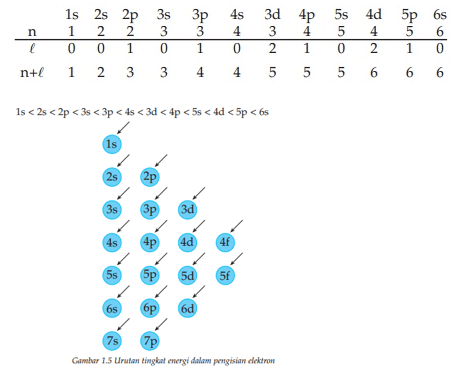
Menurut aasas ini, elektron dalam atom sebisa mungkin mempunyai daya paling rendah. Pengisian elektron pada orbital senantiasa dimulai dari orbital 1s atau tingkat daya paling rendah. Bila orbitas 1s udah penuh, elektron bakal masuk kedalam orbital 2s, demikian seterusnya.
Besarnya tingkat orbital tergantung pada harga bilangan kuantum paling utama (n) serta bilangan kuantum azimuth (l). Orbital dengan harga n+ l lebih besar memiliki tingkat daya lebih besar. Apabila harga n+ l sama orbital yang memiliki harga n lebih besar memiliki daya yang lebih besar.
Urutan tingkat daya dalam pengisian elektron sebagai berikut ini:
Larangan Pauli
Azas larangan pauli mengatakan tidak mungkin dalam sebuah atom ada dua elektron dengan harga ke empat bilangan kuantum yang sama. Tujuannya, dalam satu atom, dua buah elektron mungkin mempunyai harga n, l, dan ml yang sama, namun harga s nya pasti tidak sama.
Jadi, larangan pauli menjelaskan sebuah orbital maksimum yang cuma bisa ditempati dua elektron yang arah spinnya berlawanan. Subkulit s memiliki 1 orbital, elektron maksimalnya 2.
- Subkulit p mempunyai 3 orbital serta elektron maksimumnya 6
- Subkulit p mempunyai 5 orbital serta elektron maksimumnya 10
- Subkulit p mempunyai 7 orbital serta elektron maksimumnya 14
Jumlah maksimum elektron pada kulit ke –n = 2n2.
Kaidah Hund
Pada pengisian orbital-orbital yang berenergi sama elektron bakal menempati orbital secara sendiri-sendiri dengan spin yang paralel kemudian baru berpasangan. Keadaan energi paling rendah yaitu yang mempunyai elektron tidak berpasangan yang paling banyak.
Misalnya pada subkulit p dengan l = 1 dan ml = +1, 0, -1 elektron maksimumnya 6. Urutan pengisian elektron dalam orbital sebagai berikut ini:

Contoh konfigurasi elektron unsur C (Z = 6)
Pengisiannya sebagai berikut ini: 2 elektron menempati orbital subkulit 1s selanjutnya 2 elektron menempati 2s dan sisanya 2 elektron menempati orbital-orbital 2p secara paralel.
Cara Penulisan Konfigurasi Elektron
Dua langkah penulisan urutan subkulit
Subkulit ditulis berdasarkan urutan tingkat energinya
Contoh:
![]()
Subkulit ditulis sesuai urutan nomer kulit yang sama kemudian untuk kulit berikutnya lebih tinggi
Contoh:
![]()
Penyingkatan memakai konfigurasi elektron gas mulia terdekat
Contoh:

Gas mulia terdekat sebelumnya adalah

Konfigurasinya bisa disingkat

Beberapa contoh yang lain:
 Orbital penuh dan setengah penuh
Orbital penuh dan setengah penuh
Berdasarkan percobaan bisa diperlihatkan kalau orbital yang terisi penuh atau setengah penuh adalah struktur yang relatif lebih stabil. Ada beberapa penyimpangan pengisian elektron berdasarkan aturan aufbau dengan berdasarkan percobaan.

Hal itu terjadi lantaran orbital setengah penuh (d5) dan penuh (d10) lebih stabil.
Konfigurasi Elektron Ion
Ion positif terbentuk dari atom netral dengan melepas elktron pada kulit terluarnya.
Penulisannya:
- Ion positip Lx+ yang artinya melepas elektron sejumlah x
- Ion negatip Ay- yang artinya menangkap elektron sejumlah y
Ion negatif terbentuk dari atom netral dengan menarik elektron untuk mengisi orbit dari subkulit terluar yang belum penuh.
Contoh:

Hubungan Konfigurasi Elektron dengan Sistem Periodik Unsur
Konfigurasi elektron dengan sistem periodek unsur senantiasa berkaitan satu sama lainnya. Dari konfigurasi elektron sebuah atom bisa diprediksikan letak unsur dalam tabel periodiknya. Konfigurasi sebenarnya mesti ditentukan dengan percobaan.
Percobaan dapat dilakukan dengan penentuan elektron valensi yang menunjukkan periode unsur dalam tabel periodik. Penentuan golongan dapat diliat dari elktron paling akhir yang mengisi subkulit. Misalnya elektron yang mengisi subkulit s pada sp terdapat pada gol IA atau IIA, elektron yang mengisi subkulit p pada sp terdapat pada gol IIIA s/d VIIIA, bila elektron paling akhir mengisi sub kulit d pada s terdapat pada gol B.
Nah, sampailah kita di akhir pembahasan kali ini, mengenai konfigurasi elektron. Mudah-mudahan ilmunya bisa bermanfaat untuk kita semua, ya. Dan, jika masih ada yang belum dimengerti, silakan sahabat menyampaikan pertanyaan pada kotak komentar di bawah ini.
Situs informasi dan edukasi Indonesia yang khusus menyajikan konten menarik dan segar seputar kedokteran, farmasi, dan kesehatan masyarakat.