Regulasi adalah aturan sistem yang ada di dalam tubuh makhluk hidup untuk dapat hidup seimbang, mempertahankan keadaan teratur, konservasi energi, dan sebagai respon terhadap perubahan lingkungan.
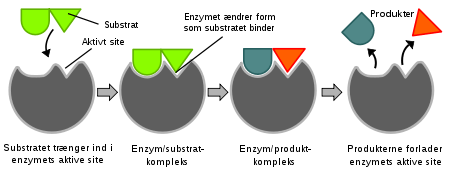
Regulasi enzim terdapat dalam 2 bentuk, yaitu regulasi non-kovalen (noncovalent bonding) dan regulasi modifikasi kovalen (covalent modification).
Regulasi non-kovalen adalah terikatnya efektor oleh (biasanya) produk pada daerah alosterik (allosteric effector) secara nonkovalen (Gambar 1.1).
Regulasi modifikasi kovalen adalah menempelnya gugus kimia (misalnya fosfat atau nukleotida) pada enzim. Regulasi enzim pada metabolisme tersebut sangat kompleks.
DAFTAR ISI:
4 Regulasi Enzim
Oleh karena itu, regulasi enzim dapat dicapai dengan mengubah konsentrasi dan aktivitas enzimatik melalui:
1. Kontrol genetika
Pada proses kontrol genetika, terdapat beberapa proses, yaitu Represi dan induksi enzim. Represi enzim merupakan salah satu bentuk dari kontrol negatif pada transkripsi bakteri.
Proses tersebut, begitu pun dengan induksi enzim, disebut sebagai kontrol negatif karena protein regulatornya akan menyebabkan inhibisi atau penghambatan dari sintesis mRNA sehingga akan menyebabkan penurunan proses sintesis enzim-enzim.
Sekalipun inhibisi balik akan menghentikan sintesis dari produk akhir dari suatu pathway, proses ini masih memungkin terbuangnya energi dan karbon karena pembentukkan enzim yang tidak diperlukan (karena sudah diinhibisi) masih dilanjutkan.
Proses represi enzim bertujuan untuk mencegah sintesis enzim yang turut terlibat dalam pembentukan suatu produk akhir.
Pada kasus biosintesis triptofan (gambar 3), produk akhir dari pathway, triptofan, berperan sebagai sebuah molekul efektor yang dapat menghentikan sintesis dari Enzim a, b, c, d, dan e yang turut terlibat pada biosintesis triptofan.
Dengan demikian maka akan menghemat banyak molekul ATP yang seharusnya dikeluarkan selama proses sintesis protein, dan menjaga prekusor asam amino untuk sintesis protein lain.
Proses ini berlangsung lambat dibandingkan dengan inhibisi balik (yang bekerja sesegera mungkin) karena enzim-enzim yang sudah ada harus dikurangi jumlahnya sebagai hasil dari pembelahan sel sebelum efeknya benar-benar terlihat.
2. Modifikasi Kovalen
Meskipun sebagian besar enzim diregulasi secara non-kovalen, tetapi terdapat beberapa enzim atau protein yang diregulasi secara modifikasi kovalen.
Modifikasi kovalen pada enzim atau protein biasanya dilakukan oleh gugus asetil, fosfat, metil, adenil, dan uridil. Modifikasi kovalen biasanya merupakan perlekatan dapat pulih (tidak permanen).
| Enzim | Modifikasi |
| Glutamin sintetase E. coliIsositrat liase E. coliIsositrat dehidrogenase E. coliHistidin protein kinase sebagian besar bakteriProtein regulator fosforilasi sebagian besar bakteri
Sitrat liase pada Rhodopseudomonas Protein kemotaksis E. coli |
AdenilisasiFosforilasiFosforilasiFosforilasiFosforilasi Asetilasi Metilasi |
Tabel 2.1 Enzim yang diregulasi secara modifikasi kovalen
3. Enzim Allosterik
Enzim allosterik merupakan enzim regulator yang memiliki dua sisi katalik. Salah satu sisi ikatannya untuk substrat dan yang satunya sisi regulator yang berfungsi untuk memodulasi aktivitas enzim.
Sisi allosterik memiliki ikatan nonkovalen pada dan interaksinya bersifat reversible. Sisi allosterik ini akan mengikat senyawa pengatur yang disebut efektor atau modulator. Enzim allosterik ini dapat dipacu atau dihambat oleh modulatornya.
Sebagai contoh mekanisme penghambatan balik pada pengubahan L-teronin menjadi L-isoleusin yang menggunakan lima macam enzim.
Enzim yang pertama adalah dehidratase treonin (E1) akan dihambat oleh L-isoleusin yang merupakan produk akhir dari reaksi multienzim tersebut (Lehninger, 2004).
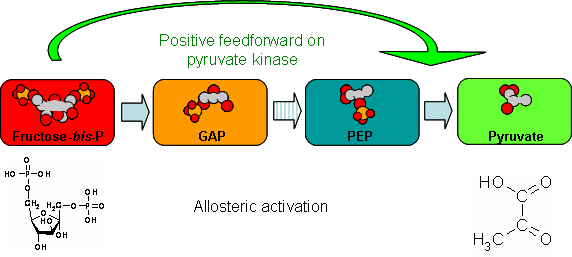
Berdasarkan modulasinya, enzim allosterik dibedakan menjadi dua kelompok yakni enzim allosterik homotropik dan enzim allosterik heterotropik.
Pada enzim allosterik homotropik substrat berperan sebagai modulator. Hal ini dikarenakan subtrat identik dengan modulator. Sementara pada enzim allosterik heterotropik, modulasinya tidak dipengaruhi oleh substratnya sendiri.
4. Kompartementasi
Kompartementasi enzim akan meningkatkan efisiensi banyak proses yang berlangsung didalam sel, karena:
- Reaktan tersedia pada tempat dimana enzim tersedia
- Senyawa yang akan dikonversi dikirim kearah enzim yang akan berperan untuk menghasilkan produk sesuai yang dikehendaki dan tidak disimpangkan pada lintasan yang lain.
Hasil suatu tahap reaksi akan dibebaskan pada tempat dimana hasil ini dapat segera dikonservasi oleh enzim berikutnya. Proses ini berlangsung terus–menerus sampai dihasilkan produk akhirnya.
Daftar Pustaka
- Kid, 2011. Regulasi Allosterik pada Enzim.[Online]. Tesedia: http://kid.blogspot.com/2011/12/regulasi-alosterik-pada-enzim.html
- Lehninger, Albert L.1982. Dasar-Dasar Biokimia. Erlangga: Jakarta
- Mardjono, Mahar. 2007. Farmakologi dan Terapi, Jakarta; Universitas Indonesia Press.
Situs informasi dan edukasi Indonesia yang khusus menyajikan konten menarik dan segar seputar kedokteran, farmasi, dan kesehatan masyarakat.